MINI RECENSIONE
L’avamposto contro il cancro: i marcatori universali del cancro
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Cina;2 Dipartimento di Chirurgia Generale, Primo Ospedale Affiliato dell'Università di Medicina di Harbin, Harbin 150001, Cina;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Cina;4 Ospedale popolare della regione autonoma di Ningxia Hui, Università medica di Ningxia, Yinchuan 750002, Cina;5Centro clinico di sanità pubblica di Shanghai e Dipartimento di chirurgia generale, Ospedale di Huashan, Istituto di metastasi tumorali e Laboratorio di epigenetica dell'RNA, Istituti di scienze biomediche, Shanghai Medical College, Università di Fudan, Shanghai 200032, Cina
ASTRATTO
Il cancro è la principale causa di morte nel mondo.La diagnosi precoce del cancro può ridurre la mortalità di tutti i tipi di cancro;tuttavia, per la maggior parte dei tipi di cancro mancano biomarcatori efficaci per la diagnosi precoce.La metilazione del DNA è sempre stata uno dei principali obiettivi di interesse perché la metilazione del DNA di solito avviene prima di altri cambiamenti genetici rilevabili.Durante lo studio delle caratteristiche comuni del cancro utilizzando una nuova guida per il posizionamento del sequenziamento per la metilazione del DNA, una serie di marcatori universali solo per il cancro (UCOM) sono emersi come forti candidati per una diagnosi precoce efficace e accurata del cancro.Mentre il valore clinico degli attuali biomarcatori tumorali è ridotto dalla bassa sensibilità e/o dalla bassa specificità, le caratteristiche uniche degli UCOM garantiscono risultati clinicamente significativi.La convalida del potenziale clinico degli UCOM nei tumori del polmone, della cervice, dell’endometrio e dell’urotelio supporta ulteriormente l’applicazione degli UCOM in più tipi di cancro e vari scenari clinici.Infatti, le applicazioni degli UCOM sono attualmente oggetto di studio attivo con ulteriori valutazioni nella diagnosi precoce del cancro, nella diagnosi ausiliaria, nell’efficacia del trattamento e nel monitoraggio delle recidive.I meccanismi molecolari attraverso i quali gli UCOM rilevano i tumori sono i prossimi importanti argomenti da indagare.Anche l’applicazione degli UCOM negli scenari del mondo reale richiede implementazione e perfezionamento.
PAROLE CHIAVE
Rilevazione del cancro;screening del cancro;Metilazione del DNA;epigenetica del cancro;biomarcatori del cancro
Perché abbiamo urgentemente bisogno di nuovo biomarcatori?
Dopo aver combattuto il cancro per oltre un secolo, il cancro rappresenta ancora la minaccia biologica più letale per l’umanità.Il cancro rimane un problema sanitario globale con 19,3 milioni di nuovi casi e quasi 10 milioni di decessi stimati nel 20201. Nel 2020 si stima che siano stati diagnosticati 4,6 milioni di nuovi casi di cancro in Cina, pari al 23,7% dei nuovi casi di cancro a livello globale secondo GLOBOCAN1.Inoltre, nel 2020 in Cina circa 3 milioni di decessi sono stati attribuiti al cancro, ovvero il 30% dei decessi globali correlati al cancro1.Queste statistiche hanno indicato che la Cina è al primo posto nell’incidenza e nel tasso di mortalità del cancro.Inoltre, il tasso di sopravvivenza al cancro a 5 anni è del 40,5%, ovvero 1,5 volte inferiore al tasso di sopravvivenza a 5 anni negli Stati Uniti2,3.I tassi di sopravvivenza e di mortalità relativamente più bassi in Cina rispetto ai paesi con indici di sviluppo umano più elevati suggeriscono che è urgentemente necessario un sistema di prevenzione e sorveglianza del cancro efficiente ed economicamente vantaggioso.La diagnosi precoce del cancro è uno degli elementi più critici in un sistema sanitario.La diagnosi precoce del cancro può migliorare la prognosi e la sopravvivenza in fase precoce in quasi tutti i tipi di cancro4.Strategie di screening efficaci hanno portato a un calo significativo dell’incidenza e dei tassi di mortalità dei tumori della cervice, della mammella, del colon-retto e della prostata.
Ottenere una diagnosi precoce del cancro, tuttavia, non è un compito facile.Lo studio della biologia e della prognosi del cancro in fase iniziale, l'identificazione e la convalida di biomarcatori affidabili per la diagnosi precoce e lo sviluppo di tecnologie di diagnosi precoce accessibili e accurate sono sempre stati i maggiori ostacoli nel processo4.Il rilevamento preciso del cancro può distinguere le lesioni benigne da quelle maligne, il che aiuta a evitare procedure non necessarie e facilita l’ulteriore gestione della malattia.Le attuali strategie di diagnosi precoce includono biopsie basate su endoscopio, imaging medico, citologia, test immunologici e test sui biomarcatori5-7.Essendo invasive e costose, le biopsie effettuate con l'endoscopio comportano un onere intrinsecamente pesante in quanto procedura medica importante che fa affidamento su personale professionale.Come la citologia, entrambi i metodi di screening dipendono dai professionisti medici e si basano sul giudizio personale con prestazioni tutt'altro che ideali8.Al contrario, i test immunologici sono altamente imprecisi, dati gli alti tassi di falsi positivi.L’imaging medico, come tattica di screening, richiede attrezzature costose e tecnici specializzati.Pertanto, l’imaging medico è estremamente limitato a causa della scarsa accessibilità.Per tutte queste ragioni, i biomarcatori sembrano essere un’opzione migliore per la diagnosi precoce del cancro.
Corrispondenza con: Yinshan Li e Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 e
https://orcid.org/0000-0001-9920-1133
Ricevuto il 22 agosto 2023;accettato il 12 ottobre 2023;
pubblicato online il 28 novembre 2023.
Disponibile su www.cancerbiomed.org
©2023 Biologia e medicina del cancro.Creative Commons
Licenza Internazionale Attribuzione-NonCommerciale 4.0
I biomarcatori sono attualmente classificati come proteine, marcatori di mutazioni del DNA, marcatori epigenetici, anomalie cromosomiche, marcatori di RNA derivati direttamente da tumori o frammenti tumorali ottenuti indirettamente da fluidi corporei.I marcatori proteici sono i biomarcatori più ampiamente applicati nello screening e nella diagnosi del cancro.I biomarcatori proteici, come biomarcatori di screening, sono limitati dalla tendenza a essere colpiti da lesioni benigne, il che porta a sovradiagnosi e sovratrattamenti, come è stato riportato per l'α-fetoproteina e l'antigene prostatico specifico (PSA)9,10.I marcatori di RNA includono modelli di espressione genetica e altri marcatori di RNA non codificanti. Una combinazione di marcatori di RNA di espressione genetica può essere rilevata utilizzando campioni di urina, la cui sensibilità era lungi dall'essere soddisfacente (60%) per i tumori primari e il cui rilevamento può essere influenzato dalla facile degradazione dell'RNA nell'ambiente normale11.Entrambi i marcatori genetici ed epigenetici affrontano il problema della prevalenza dei tumori e della limitazione dei tipi di cancro.
La metilazione del DNA è stata un forte candidato come biomarker per la diagnosi precoce da quando Feinberg è stata collegata per la prima volta al cancro nel 198312. Le aberrazioni della metilazione del DNA sono osservate in tutti gli stadi del cancro, già nello stadio precanceroso.L'ipermetilazione aberrante del DNA di solito avviene sulle isole CpG nei promotori dei geni per contrastare i soppressori tumorali13,14.Gli studi hanno anche suggerito che l'ipermetilazione anormale del DNA è coinvolta nella sovraregolazione dei regolatori dello sviluppo15.La valle di metilazione del DNA, che è comunemente associata a regolatori dello sviluppo e tumori ipermetilati, potrebbe cambiare la modalità di espressione genetica in una modalità più stabile dipendente dalla metilazione del DNA e diminuire la connessione con l'istone metilato H3K27me3 e le proteine polycomb associate16,17.
Tra il gran numero di marcatori di metilazione del DNA pubblicati, molti hanno debuttato con successo sul mercato;tuttavia, i marcatori di metilazione del DNA e i pannelli diagnostici attualmente commercializzati devono ancora sfruttare appieno il potenziale della diagnosi precoce del cancro per molteplici ragioni18.Sebbene mostrino per lo più prestazioni accettabili utilizzando le informazioni del database, questi biomarcatori di solito funzionano in modo meno ideale nel mondo reale a causa del fatto che i campioni del mondo reale sono spesso più complessi e non così rappresentativi come quelli selezionati nei database.È stato dimostrato che la rilevazione precoce della metilazione multi-cancro basata sul sequenziamento di nuova generazione ha una sensibilità pari solo al 16,8% e al 40,4% rispettivamente nei tumori di stadio I e II19.I test di diagnosi precoce richiedono maggiore stabilità e biomarcatori più accurati.
Scoperta del marcatore universale del cancro (UCOM) utilizzando il sequenziamento del posizionamento della guida (GPS)
Nonostante decenni di ricerca sul cancro, non sono stati realizzati né una prevenzione né un trattamento soddisfacenti.Sono necessarie nuove metodologie per consentire ai ricercatori di valutare approfonditamente il cancro.Negli ultimi 23 anni, 6 caratteristiche del cancro, come l’elusione dell’apoptosi, l’invasione dei tessuti e le metastasi, ecc., sono state estese a 14 includendo caratteristiche come la riprogrammazione epigenetica non mutazionale e i microbiomi polimorfici20,21.Man mano che vengono svelati maggiori dettagli sul cancro, nuove prospettive vengono introdotte nella ricerca sul cancro.La ricerca sul cancro è gradualmente entrata in una nuova era in due direzioni (comune e individualità).Con lo sviluppo dell’oncologia di precisione negli ultimi anni, il focus della ricerca sul cancro si sta orientando verso una terapia mirata individualizzata e verso l’eterogeneità del cancro22.Pertanto, i biomarcatori tumorali recentemente identificati si sono concentrati principalmente su specifici tipi di cancro, come il cancro forzacervicale PAX623 e BMP3 per il cancro del colon-retto24.La prestazione di questi biomarcatori specifici per i tipi di cancro varia, ma non è ancora possibile per i soggetti suscettibili sottoporsi allo screening per tutti i tumori contemporaneamente a causa della limitazione dell’acquisizione di campioni biologici e dei costi elevati.L’ideale sarebbe se potessimo identificare un unico biomarcatore robusto che sia efficace per tutti i tipi di cancro in fase iniziale.
Per raggiungere questo obiettivo ideale, è necessario selezionare un candidato biomarcatore migliore dall’elenco dei potenziali tipi di biomarcatori.È noto che le aberrazioni della metilazione del DNA, tra tutti i profili genetici ed epigenetici, sono correlate al cancro e sono alcune delle prime, se non le prime, anomalie correlate al cancro a verificarsi in ordine cronologico.Lo studio sulla metilazione del DNA è iniziato presto, ma è stato ostacolato dalla mancanza di metodi di ricerca.Tra i 28 milioni di potenziali siti CpG metilati nel genoma, un numero gestibile deve essere rilevato e allineato al genoma per comprendere meglio la tumorigenesi.Il sequenziamento dell’intero genoma con bisolfito (WGBS), considerato il gold standard del sequenziamento della metilazione del DNA, può coprire solo il 50% del C nelle cellule tumorali a causa della natura del trattamento con bisolfito che rompe frammenti di DNA e riduce la complessità del genoma durante la trasformazione di Cs-in-Ts25.Altri metodi, come i chip da 450.000, coprono solo l’1,6% della metilazione del genoma.Sulla base di 450.000 dati, un pannello di rilevamento della metilazione del DNA ha una sensibilità del 35,4% per 6 tipi di cancro allo stadio I26.Le limitazioni relative ai tipi di cancro, le scarse prestazioni e il rumore generato dai metodi di rilevamento nel processo analitico sono diventati i maggiori ostacoli per i pannelli di rilevamento del pan-cancro.
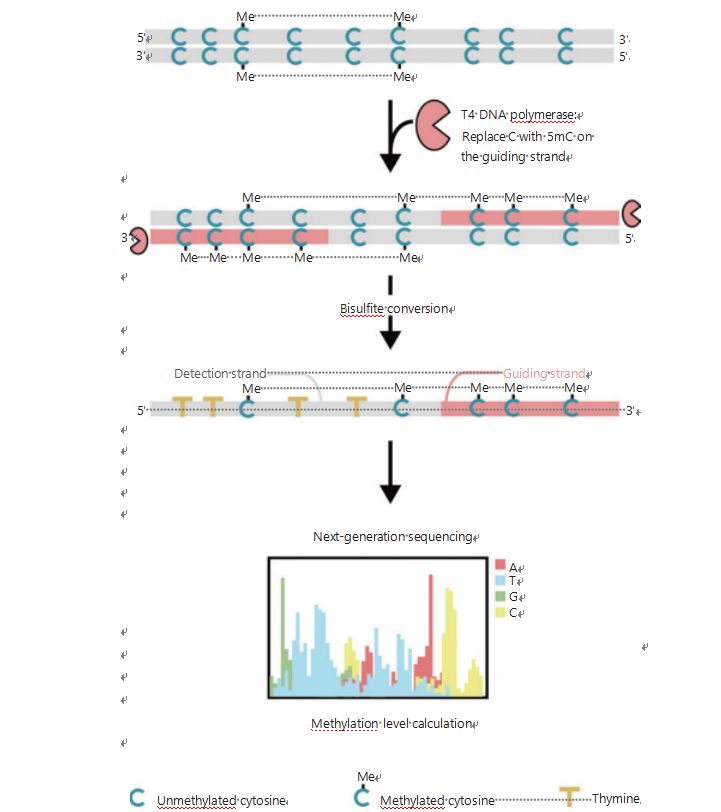
Per studiare meglio i modelli epigenetici delle cellule durante la tumorigenesi e le metastasi, abbiamo sviluppato un GPS unico per il rilevamento della metilazione del DNA a livello genomico, che copre fino al 96% dei siti CpG in 0,4 miliardi di letture25.Il GPS è un metodo di sequenziamento bilaterale che utilizza un'estremità 3' del frammento di DNA di metil-citosine non convertibili dopo il trattamento con bisolfito che guida l'allineamento del calcolo della metilazione del DNA dell'estremità 5' attraverso il sequenziamento di coppia (Figura 1)25.Il filamento guida della metil-citosina, agendo come filamento modello, aiuta nell'allineamento della regione ad alto GC che recupera i dati di sequenziamento più abbandonati nel WGBS tradizionale.L’elevata copertura del GPS fornisce un’enorme quantità di informazioni sulla metilazione del DNA, che ci consente di esaminare i profili di metilazione del cancro con una risoluzione notevolmente più elevata in regioni precedentemente poco studiate.
Il GPS ci fornisce un potente strumento per studiare l’omogeneità del cancro, che può semplificare notevolmente la ricerca sul cancro e potenzialmente trovare una spiegazione universale per la tumorigenesi e le metastasi.Durante l'analisi dei dati GPS delle linee cellulari tumorali, è stato spesso riscontrato un fenomeno unico.C'erano un certo numero di regioni che sembravano essere anormalmente ipermetilate in diversi tipi di campioni di cancro.Questa scoperta inaspettata è stata successivamente convalidata per fungere da UCOM.Sono stati analizzati più di 7.000 campioni provenienti da 17 tipi di cancro nel database The Cancer Genome Atlas (TCGA), tra i quali abbiamo identificato il primo UCOM, HIST1H4F, un gene correlato all'istone che è ipermetilato in tutti i tipi di cancro27.Una serie di UCOM è stata quindi trovata e convalidata nel database TCGA, nel database Gene Expression Omnibus (GEO) e in campioni clinici reali.A partire da ora, HIST1H4F, PCDHGB7 e SIX6 sono stati trovati e convalidati come UCOM.L’inaspettata scoperta degli UCOM offre una potente risposta alla necessità di una diagnosi precoce del cancro.Gli UCOM forniscono una soluzione per il rilevamento di un singolo marcatore di più tumori.
Caratteristiche degli UCOM
Dopo la convalida, è stato dimostrato che gli UCOM presentano quattro caratteristiche principali che consentono agli UCOM di superare l'efficacia degli attuali biomarcatori (Figura 2).
Unico per tumore maligno
Gli UCOM sono tipici delle lesioni cancerose o precancerose e non sono influenzati dai normali cambiamenti fisiologici.Alcuni degli attuali marcatori correlati al cancro che sono stati ampiamente applicati nella diagnosi precoce e/o nello screening hanno portato a una sovradiagnosi.Livelli elevati di PSA, uno strumento di screening clinicamente accreditato, vengono rilevati anche in condizioni benigne, come l'iperplasia prostatica e la prostatite10.La sovradiagnosi e il conseguente sovratrattamento portano ad una ridotta qualità della vita a causa di complicazioni intestinali, urinarie e sessuali28.Altri biomarcatori basati sulle proteine e ampiamente utilizzati in ambito clinico, come il CA-125, non hanno prodotto benefici significativi pur incorrendo in sovradiagnosi e sovratrattamenti29.L'elevata specificità degli UCOM per le neoplasie maligne evita queste carenze.L'UCOM, PCDHGB7, distingue in modo efficiente le lesioni intraepiteliali squamose di alto grado (HSIL) e il cancro cervicale dai campioni normali e le lesioni intraepiteliali squamose di basso grado (LSIL), mentre la maggior parte degli altri biomarcatori possono solo differenziare il cancro cervicale dai campioni normali30.Sebbene PCDHGB7 non rilevi differenze significative tra endometrio normale e iperplasia endometriale, vengono rilevate differenze significative tra endometrio normale e iperplasia atipica e differenze ancora maggiori vengono rilevate tra endometrio normale e cancro endometriale (EC) in base a PCDHGB731.Gli UCOM sono unici per le lesioni maligne nei database e nei campioni clinici.Dal punto di vista del paziente, UCOM unici riducono la soglia per comprendere le indicazioni complesse di vari biomarcatori instabili con scarse prestazioni e la corrispondente ansia durante il processo di valutazione.Dal punto di vista del medico, UCOM unici differenziano le neoplasie dalle lesioni benigne, il che aiuta nel triage dei pazienti e riduce le procedure mediche non necessarie e il trattamento eccessivo.Pertanto, UCOM unici riducono la ridondanza del sistema medico, alleviano le difficoltà del sistema e mettono a disposizione più risorse mediche a chi ne ha bisogno.
Figura 1 Schema del flusso di lavoro GPS per il rilevamento della metilazione del DNA25.Linea grigia: sequenza di DNA in ingresso;linea rossa: DNA trattato con DNA polimerasi T4, sostituendo la citosina con 5'-metilcitosina all'estremità 3' dell'input;C blu con Me: citosina metilata;blu C: citosina non metilata;giallo T: timina25.
Tutto o niente
Gli UCOM sono presenti solo nelle cellule tumorali e vengono rilevati stabilmente in quasi tutte le cellule tumorali.È stato convalidato che HIST1H4F è ipermetilato in quasi tutti i tipi di tumore ma non nei campioni normali27.Allo stesso modo, è stato dimostrato che anche PCDHGB7 e SIX6 sono ipermetilati in tutti i campioni tumorali ma non nei campioni normali30-32.Questa caratteristica unica migliora significativamente le prestazioni degli UCOM rispetto al limite di rilevamento e sensibilità.Solo il 2% delle cellule tumorali può essere differenziato nei campioni, rendendo gli UCOM un biomarcatore molto più sensibile rispetto alla maggior parte dei biomarcatori esistenti30. Essendo un biomarcatore utilizzato per il rilevamento del cancro del colon-retto, le mutazioni KRAS esistono solo in circa il 36% dei casi di cancro del colon-retto. suggerendo uno scarso potenziale diagnostico33.La bassa prevalenza delle mutazioni KRAS nel cancro del colon-retto limita il KRAS in combinazione con altri biomarcatori.Infatti, una combinazione di biomarcatori potrebbe sembrare inizialmente promettente, ma non sempre genera un risultato soddisfacente, dimostrando un rumore molto maggiore nell'analisi di rilevamento e solitamente comporta procedure sperimentali più complicate.Al contrario, PCDHGB7 e altri UCOM esistono in tutti i tumori.Gli UCOM rilevano componenti cancerosi in diversi tipi di campioni di cancro con la massima precisione, eliminando al contempo i complessi processi di analisi di cancellazione del rumore.Non è difficile individuare il cancro in un campione abbondante, ma è estremamente difficile individuare il cancro in un campione piccolo.Gli UCOM sono in grado di rilevare piccole quantità di cancro.
Figura 2 Caratteristiche degli UCOM.
Rilevazione del cancro che precede i cambiamenti patologici
Gli UCOM possono essere rilevati nella fase precancerosa prima dei cambiamenti patologici.Come biomarcatori epigenetici, le anomalie UCOM si verificano in uno stadio precedente rispetto alle anomalie fenotipiche e sono rilevabili durante la tumorigenesi, la progressione e la metastasi34,35.La sensibilità dell'UCOM nel tempo migliora le prestazioni dell'UCOM nel rilevamento del cancro in stadio iniziale e delle lesioni precancerose.Il rilevamento precoce del cancro basato su biopsie e citologia può essere difficile anche per i patologi più esperti.Una singola biopsia acquisita tramite colposcopia è stata segnalata come positiva nel 60,6% dei campioni HSIL+.Per lesioni multiple sono necessarie biopsie aggiuntive per aumentare la sensibilità36.Al contrario, l’UCOM, PCDHGB7, ha una sensibilità dell’82% per i campioni HSIL+, superando la sensibilità delle biopsie e della maggior parte dei biomarcatori30.Il marcatore di metilazione, FAM19A4, ha una sensibilità del 69% per CIN2+, che è simile alla citologia, ma non è in grado di differenziare CIN1 dai campioni normali37.Gli UCOM hanno dimostrato di essere un biomarcatore di diagnosi precoce molto più sensibile.Rispetto ai patologi basati sull’esperienza, gli UCOM hanno una sensibilità di rilevamento superiore per i tumori in stadio iniziale, che a sua volta contribuisce a migliorare la prognosi del cancro e la sopravvivenza30.Inoltre, gli UCOM offrono una piattaforma di rilevamento accessibile alle aree in cui mancano patologi esperti e migliora notevolmente l'efficienza di rilevamento.Con procedure di campionamento e rilevamento uniformi, il rilevamento UCOM produce risultati stabili e facili da interpretare che si adattano meglio a un protocollo di screening che richiede meno personale professionale e risorse mediche.
Facile da rilevare
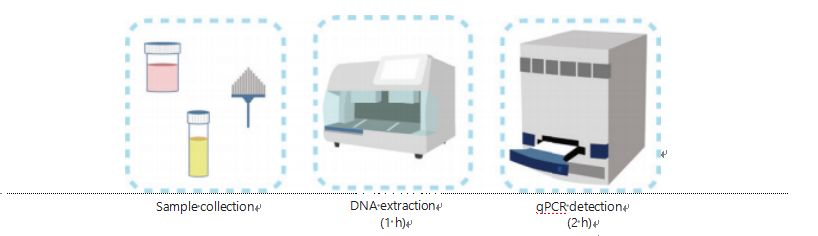
Gli attuali metodi per il rilevamento della metilazione del DNA sono complicati e richiedono molto tempo.La maggior parte dei metodi richiede la trasformazione del bisolfito, che causa una perdita di qualità del campione e può produrre risultati instabili e imprecisi.La scarsa riproducibilità causata dal trattamento con bisolfito porta potenzialmente a confusione per medici e pazienti e interferisce ulteriormente con il follow-up e/o le strategie di trattamento.Pertanto, abbiamo ulteriormente modificato il metodo di rilevamento dell'UCOM per evitare il problematico trattamento con bisolfito dei campioni, soddisfare i requisiti dell'applicazione clinica e migliorare l'accessibilità.Abbiamo sviluppato un nuovo metodo utilizzando enzimi di restrizione sensibili alla metilazione combinati con PCR quantitativa fluorescente in tempo reale (Me-qPCR) per quantificare lo stato di metilazione degli UCOM entro 3 ore utilizzando procedure di facile gestione (Figura 3).Me-qPCR può ospitare più tipi di campioni, come la raccolta clinica di fluidi corporei e campioni di urina raccolti autonomamente.I campioni clinici raccolti possono essere elaborati, archiviati e procedere facilmente al rilevamento utilizzando l'estrazione del DNA standardizzata e automatizzata.Il DNA estratto può quindi essere applicato direttamente alla piattaforma Me-qPCR per una reazione one-pot e ottenere risultati di quantificazione.Dopo una semplice analisi dei risultati utilizzando modelli diagnostici adattati e convalidati per specifici tipi di cancro, la determinazione finale dei risultati di rilevamento dell'UCOM viene interpretata e presentata come valore semiquantitativo.La piattaforma Me-qPCR supera il tradizionale pirosequenziamento con bisolfito nel rilevamento UCOM risparmiando 3 ore di conversione del bisolfito, secondo il protocollo del kit EZ DNA Methylation-Gold.L'innovativa piattaforma di rilevamento della metilazione rende il rilevamento UCOM più stabile, più accurato e più accessibile30.
Figura 3 Processo di rilevamento degli UCOM.I tipi di campioni includono BALF campionato professionalmente, spazzolino per Pap test e/o urina raccolta autonomamente.Il processo di estrazione del DNA può essere affidato a un estrattore automatico, il cui prodotto può essere rilevato direttamente mediante qPCR.
Applicazione degli UCOM
Cancro ai polmoni
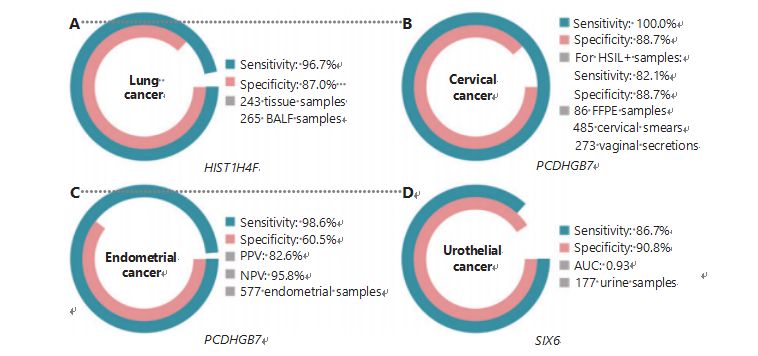
Il cancro del polmone è il secondo tumore più frequentemente diagnosticato e più letale a livello mondiale, rappresentando l’11,4% dei nuovi casi e il 18,0% dei nuovi decessi1.Tra tutte le diagnosi, l'85% è di cancro del polmone non a piccole cellule (NSCLC) e il 15% è di cancro del polmone a piccole cellule (SCLC), che ha un livello di malignità più elevato38.La tomografia computerizzata a basso dosaggio (LDCT) è il metodo di screening attualmente raccomandato per il cancro del polmone e ha dimostrato di migliorare la diagnosi precoce e di ridurre la mortalità6;tuttavia, a causa della bassa specificità e della scarsa accessibilità, l'LDCT deve ancora fungere da metodo di screening soddisfacente, così come altri marcatori tumorali comuni, come il CEA39.I costi e il rischio di diagnosi mancate ed errate della strategia di screening LDCT ostacolano il progresso della promozione dello screening del cancro del polmone40.HIST1H4F, un UCOM, ha un enorme potenziale come biomarcatore di rilevamento precoce nei campioni di fluido broncoalveolare (BALF)27.HIST1H4F è ipermetilato nell'adenocarcinoma polmonare e nel carcinoma a cellule squamose del polmone, con una specificità di rilevamento del 96,7% e una sensibilità dell'87,0% (Figura 4A) e una prestazione eccezionale per i tumori allo stadio I27.HIST1H4F ha una specificità del 96,5% e una sensibilità dell'85,4% per NSCLC e rispettivamente del 96,5% e 95,7% per SCLC27.Inoltre, campioni di altri otto tipi di cancro, compresi i tumori del pancreas e del colon-retto, hanno convalidato che HIST1H4F è ipermetilato in tutti gli otto tipi27.
Cancro cervicale
Il cancro della cervice è stato il quarto tumore più frequentemente diagnosticato e la quarta causa principale di decessi per cancro nelle donne nel 2020, rappresentando il 3,1% dei nuovi casi e il 3,4% dei decessi correlati al cancro a livello globale1.Per eliminare il cancro alla cervice entro il 2030, come proposto dall’OMS, la diagnosi precoce del cancro alla cervice è una necessità.Se rilevato in fase precoce, il tasso di sopravvivenza a 5 anni raggiunge il 92% nel cancro cervicale invasivo41.Le linee guida dell'American Cancer Society (ACS) suggeriscono test citologici cervicali, test HPV primari o cotest per lo screening42.La citologia cervicale è invasiva e può rilevare solo il 63,5% dei casi CIN2+37.
PCDHGB7, al contrario, ha ottenuto risultati molto migliori utilizzando il Pap test e le secrezioni vaginali e può differenziare efficacemente HSIL da LSIL in uno stadio ultra-precoce.Il solo PCDHGB7 ha una sensibilità del 100,0% e una specificità dell'88,7% per il cancro cervicale (Figura 4B) e una sensibilità dell'82,1% e una specificità dell'88,7% per i campioni HSIL+30.PCDHGB7 ha anche una sensibilità del 90,9% e una specificità del 90,4% nei campioni di secrezioni vaginali per il cancro della cervice, che sono molto più facili da raccogliere30.Se combinato con il test HPV ad alto rischio (hr) o con il test citologico Thinprep (TCT), PCDHGB7 ha una sensibilità aumentata del 95,7% e una specificità del 96,2%, superando significativamente quella del test hrHPV (20,3%), TCT (51,2% ) e i due combinati (57,8%) per il cancro della cervice30.È stato inoltre dimostrato che PCDHGB7 è ipermetilato in 17 tipi di cancro dal database TCGA, indicando la sua idoneità nella famiglia UCOM30.
Figura 4 Gli UCOM sono stati convalidati in quattro tipi di cancro in studi clinici su larga scala.A. Prestazioni di HIST1H4F, un UCOM, nel rilevamento del cancro polmonare di 508 campioni.B. Prestazioni di PCDHGB7, un UCOM, nel rilevamento del cancro cervicale di 844 campioni.C. Prestazioni di PCDHGB7, un UCOM, nel rilevamento del cancro endometriale di 577 campioni endometriali Pap e Tao brush.D. Prestazioni di SIX6, un UCOM, nel rilevamento del cancro uroteliale di 177 campioni.
EC
L'EC è uno dei tumori dell'apparato riproduttivo femminile più comuni a livello mondiale, con circa 4,2 milioni di nuovi casi e l'1% di decessi correlati al cancro ogni anno1.Con una diagnosi positiva in fase iniziale, la CE è curabile e ha un tasso di sopravvivenza a 5 anni del 95% per il cancro in stadio I.I pazienti che presentano sintomi, come sanguinamento uterino anomalo, ricevono una valutazione clinica periodica e vengono sottoposti a procedure bioptiche invasive e dolorose, nonostante solo il 5%-10% sviluppi infine EC43.L'ecografia transvaginale, come metodo di rilevamento comune, è altamente inaffidabile a causa della sua incapacità di differenziare i cambiamenti endometriali benigni da quelli maligni e dell'alto tasso di falsi positivi44.
È stato condotto un confronto parallelo tra il CA-125 sierico, un biomarcatore CE ampiamente implementato, e il PCDHGB7.Il CA-125 sierico aveva una sensibilità del 24,8%, il che suggerisce che il CA-125 è un marcatore inadeguato per la CE nonostante una specificità del 92,3%31.Il rilevamento di PCDHGB7 utilizzando campioni di spazzolino Pap ha prodotto una sensibilità dell'80,65% e una specificità dell'82,81% per gli stadi ECatall, mentre uno spazzolino Tao aveva una sensibilità del 61,29% e una specificità del 95,31%31.Il modello diagnostico PCDHGB7, basato su Me-qPCR, ha prodotto una sensibilità del 98,61%, una specificità del 60,5% e un'accuratezza complessiva dell'85,5%, utilizzando campioni di Pap e Tao brush (Figura 4C)31.
Cancro uroteliale
Il cancro uroteliale, costituito da tumori della vescica, della pelvi renale e dell’uretere, è stato il settimo tumore più frequentemente diagnosticato nel 2020 a livello mondiale, causando il 5,2% di nuovi casi e il 3,9% di decessi1.I tumori uroteliali, di cui oltre il 50% sono tumori della vescica, sono stati il quarto tumore più frequentemente diagnosticato negli Stati Uniti nel 2022, rappresentando l’11,6% dei casi di nuova diagnosi3.Circa il 75% dei tumori della vescica sono classificati come tumori della vescica non muscolo-invasivi limitati alla mucosa o alla sottomucosa45.Una biopsia cistoscopica è il gold standard per la diagnosi del cancro uroteliale implementato mediante ibridazione in situ fluorescente (FISH) e test citologici.La FISH e la citologia hanno scarse prestazioni diagnostiche e la cistoscopia è invasiva e presenta il rischio di perdere microlesioni, interpretare erroneamente le lesioni e potenzialmente causare una diffusione o una recidiva del cancro46.È stato anche dimostrato che l'UCOM precedentemente convalidato, PCDHGB7, è ipermetilato nel cancro uroteliale, con un'area sotto la curva di 0,86, suggerendo una potenziale capacità diagnostica30.Per convalidare ulteriormente più UCOM e accogliere meglio più tipi di campioni, è stato esaminato SIX6, un nuovo UCOM, che ha mostrato un eccellente potenziale diagnostico nella diagnosi precoce del cancro uroteliale utilizzando campioni di urina sulla piattaforma Me-qPCR.Il rilevamento SIX6 utilizzando campioni di urina ha dimostrato una sensibilità competitiva dell'86,7% e una specificità del 90,8% (Figura 4D), pur essendo non invasivo e facile da acquisire32.Il potenziale di SIX6 nel monitoraggio delle metastasi e nella valutazione dell’efficacia del trattamento è attualmente oggetto di studio.
Il futuro e le sfide
Gli UCOM hanno una forte performance nel potenziale diagnostico di tumori multipli, ma c’è ancora molto lavoro da fare.Abbiamo ampliato l’elenco degli UCOM e li abbiamo convalidati attivamente in più tipi di cancro, compresi quelli tradizionalmente difficili da rilevare.I risultati di validazione dei database TCGA hanno ulteriormente corroborato l’applicazione degli UCOM in più tipi di cancro e in più situazioni.In un'indagine preliminare, gli UCOM hanno dimostrato di avere un robusto potenziale diagnostico per i colangiocarcinomi e gli adenocarcinomi pancreatici, che sono quasi impossibili da diagnosticare in fase iniziale con gli attuali metodi di screening32,47.La capacità di rilevare tumori rari con UCOM può essere utilizzata con il DNA tumorale circolante (ctDNA) mediante una piattaforma di biopsia liquida migliorata48.Uno studio che ha coinvolto un pannello di rilevamento del cancro del pancreas basato sul DNA plasmatico ha prodotto una sensibilità del 57,9%49.Nonostante l’elevata specificità, le prestazioni complessive rivelano che c’è ancora spazio per miglioramenti.
Le caratteristiche uniche degli UCOM hanno anche supportato lo studio del potenziale dell’UCOM nella valutazione dell’efficacia del trattamento e nel monitoraggio delle recidive.Secondo i Criteri di Valutazione della Risposta nei Tumori Solidi (RECIST), l’imaging medico è la metodologia raccomandata per il monitoraggio delle recidive e la valutazione dell’efficacia del trattamento, mentre i marcatori tumorali sono utilizzati da soli per la valutazione50.In realtà, tuttavia, gli approcci di imaging sono fortemente influenzati dalla frequenza e dai tempi, e quindi espongono i pazienti a rischi e costi più elevati51,52.SIX6 è stato validato come predittore di metastasi del cancro al seno32.Il monitoraggio del ctDNA basato sulla biopsia liquida consente la sorveglianza in tempo reale della malattia minima residua mesi prima del rilevamento radiologico, ritardando e prevenendo idealmente la progressione del cancro correlata alla recidiva53.Risultati preliminari suggeriscono che gli UCOM riflettono il livello di ipermetilazione cancerosa in tempo reale immediatamente dopo l'intervento chirurgico e il trattamento32.L’elevata sensibilità mostrata dagli UCOM e l’applicabilità in molteplici tipi di campioni non intrusivi consente agli UCOM di fungere da biomarcatore preciso per il monitoraggio della recidiva, pur mantenendo un’elevata compliance del paziente.
Allo stesso tempo, l’accessibilità pubblica al test è un’altra questione importante che richiede ulteriori sforzi.Mentre le collaborazioni per il rilevamento UCOM sono state adottate in più ospedali nella speranza di avvantaggiare più pazienti, rilevamenti e screening pro bono sono stati eseguiti attivamente nella Cina rurale.Gli UCOM necessitano di una migliore accessibilità per poter essere considerati uno strumento di screening fattibile, soprattutto per le aree sottosviluppate.
Sebbene i risultati dell'applicazione UCOM in termini di rilevamento precoce siano promettenti, esistono molte incognite sull'UCOM.Con l’esplorazione attiva, sono necessarie ulteriori ricerche sul motivo per cui gli UCOM sono universalmente presenti nei tumori.I meccanismi di regolazione epigenetica alla base degli UCOM meritano ulteriori indagini, il che potrebbe giustificare una nuova direzione per le terapie antitumorali.Tornando all’interazione tra omogeneità ed eterogeneità del tumore, siamo interessati al motivo per cui gli UCOM possono rappresentare un’eccezione rispetto alla maggior parte dei biomarcatori tumorali che sono strettamente collegati a specifici tipi di cancro.Il ruolo delle aberrazioni della metilazione del DNA identificate dall'UCOM nella tumorigenesi, nella progressione del tumore e nelle metastasi non è stato determinato nel processo di perdita e recupero dell'identità cellulare e richiede un'ispezione approfondita.Un altro grande interesse risiede nell'ambito dell'incorporazione del tratto di omogeneità degli UCOM con marcatori tissutali unici nella speranza di avvicinarsi al rilevamento preciso delle tracce di cancro e all'identificazione delle origini del tessuto tumorale in modo inverso.Gli UCOM possono essere uno strumento ideale per prevenire il cancro, rilevarlo e potenzialmente difenderlo ed eliminarlo.
Concedere il sostegno
Questo lavoro è stato sostenuto dal Programma nazionale di ricerca e sviluppo chiave della Cina (sovvenzione n. 2022BEG01003), dalla National Natural Science Foundation of China (sovvenzione n. 32270645 e 32000505), da una sovvenzione della Commissione sanitaria provinciale di Heilongjiang (sovvenzione n. 2020-111) e una sovvenzione dall'Heze Science and Technology Institute (sovvenzione n. 2021KJPT07).
Dichiarazione di conflitto di interessi
Wei Li è il direttore della ricerca e sviluppo di Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu fa parte del comitato consultivo scientifico di Epiprobe.W. Yu ed Epiprobe hanno approvato i brevetti in attesa relativi a questo lavoro.Tutti gli altri autori non dichiarano interessi concorrenti.
Contributi dell'autore
Ideazione e progettazione del progetto: Chengchen Qian e Wenqiang Yu.
Ha scritto il documento: Chengchen Qian.
Ha realizzato le illustrazioni: Chengchen Qian.
Revisionato e modificato il manoscritto: Xiaolong Zou, Wei Li, Yinshan Li e Wenqiang Yu.
Riferimenti
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al.Statistiche globali sul cancro 2020: stime GLOBOCAN di
incidenza e mortalità nel mondo per 36 tumori in 185 paesi.CA Cancer J Clinica.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Statistiche sul cancro in Cina e negli Stati Uniti, 2022: profili, tendenze e determinanti.Chin MedJ (inglese).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Statistiche sul cancro, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Individuazione precoce del cancro.Scienza.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategie per
screening del cancro del colon-retto.Gastroenterologia.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Screening del cancro al polmone.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P, et al.La prospettiva IARC sullo screening del cancro della cervice.N ingleseJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Le sfide della colposcopia per lo screening del cancro cervicale nei paesi a basso e medio reddito e le soluzioni dell’intelligenza artificiale.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Biomarcatori circolanti nella diagnosi e nella gestione del carcinoma epatocellulare.Nat Rev Gastroenterolo Epatolo.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Individuazione precoce del cancro alla prostata basata su Serum PSA in Europa e nel mondo: passato, presente e futuro.Nat Rev. Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Sviluppo di un test multiplex delle urine con RNA per l'individuazione e la stratificazione del carcinoma a cellule transizionali della vescica.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. L'ipometilazione distingue i geni di alcuni tumori umani dalle loro controparti normali.Natura.1983;301: 89-92.
13. Ng JM, Yu J. Promotore dell'ipermetilazione dei geni oncosoppressori come potenziali biomarcatori nel cancro del colon-retto.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Epigenomica del cancro: metilomi del DNA e mappe di modificazione degli istoni.Nat Rev. Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigazione nel panorama della metilazione del DNA del cancro.Tendenze Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, Lister R, Hou Z, Rajagopal N, Ray P, et al.Analisi epigenomica della differenziazione multilineare delle cellule staminali embrionali umane.Cellula.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Le analisi sull'intero genoma rivelano un ruolo di Polycomb nel promuovere l'ipometilazione delle valli di metilazione del DNA.Genoma biologico.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.Analisi della metilazione del DNA nel cancro: posizione rivisitata.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Convalida clinica di un test di diagnosi precoce multitumorale mirato basato sulla metilazione utilizzando un set di convalida indipendente.Anna Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.I segni distintivi del cancro.Cellula.2000;100: 57-70.
21. Hanahan D. Caratteristiche distintive del cancro: nuove dimensioni.Scov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Oncologia di precisione: chi, come, cosa, quando e quando no?Am Soc Clin Oncol Educ Libro.2017: 160-9.
23. Liu H, Meng X, Wang J. Metilazione quantitativa in tempo reale
rilevamento del gene PAX1 nello screening del cancro cervicale.IntJ Cancro al ginecolo.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Test del DNA con strumenti multitarget per lo screening del cancro del colon-retto.N ingleseJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Posizionamento della guida
il sequenziamento identifica modelli aberranti di metilazione del DNA che alterano l'identità cellulare e le reti di sorveglianza immunitaria del tumore.Genoma
Ris.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Rilevamento non intrusivo di più tumori mediante sequenziamento della metilazione del DNA libero da cellule circolanti (THUNDER): sviluppo e studi di validazione indipendenti.Anna Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.I geni correlati agli istoni sono ipermetilati nel cancro del polmone e ipermetilati
HIST1H4F potrebbe fungere da biomarcatore del cancro del pancreas.Ricerca sul cancro2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, Auvinen A, Hugosson J, Ciatto S, Nelen V, et al.Effetti sulla qualità della vita dello screening dell’antigene prostatico specifico.N ingleseJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Efficacia clinica dei test sui biomarcatori di screening del cancro offerti come servizio sanitario a pagamento: una revisione sistematica.Eur J Sanità pubblica.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et al.
PCDHGB7 ipermetilato come marcatore universale esclusivo del cancro e sua applicazione nello screening precoce del cancro cervicale.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et al.PCDHGB7 ipermetilato come biomarcatore per la diagnosi precoce del cancro dell'endometrio in campioni di spazzole endometriali e raschiamenti cervicali.Fronte Mol Biosci.2022;8:774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.Reciprocamente
modifica epigenetica esclusiva su SIX6 con ipermetilazione per il tracciamento dello stadio precanceroso e dell'emergenza delle metastasi.Obiettivo di trasduzione del segnale lì.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. Mutazione KRAS: da non farmacologica a farmacologica nel cancro.Obiettivo di trasduzione del segnale lì.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.La metilazione aberrante di p16 (INK4a) è un evento precoce nel cancro del polmone e un potenziale biomarcatore per la diagnosi precoce.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson K.D.Metilazione del DNA e malattie umane.Nat Rev. Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Matthews C, et al.Biopsie multiple e rilevamento dei precursori del cancro cervicale alla colposcopia.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Analisi di metilazione del FAM19A4
gene nei graffi cervicali è altamente efficiente nel rilevare la cervice
carcinomi e lesioni CIN2/3 avanzate.Cancro Prev Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Cancro ai polmoni.Lancetta.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Antigene carcinoembrionario (CEA) come marcatore tumorale nel cancro del polmone.Cancro ai polmoni.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Screening del cancro al polmone, versione 3.2018, Linee guida per la pratica clinica del NCCN in oncologia.J Natl Compr Canc Netw.2018;16: 412-41.
41. Società americana contro il cancro.Fatti e cifre sul cancro.Atlanta, GA, USA: American Cancer Society;2023 [aggiornato 2023 marzo 1;citato 22 agosto 2023].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Screening del cancro cervicale per soggetti a rischio medio: aggiornamento delle linee guida 2020 dell'American Cancer Society.CA Cancer J Clinica.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Associazione del rischio di cancro dell'endometrio con sanguinamento postmenopausale nelle donne: una revisione sistematica e una meta-analisi.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Sensibilità dello screening ecografico transvaginale
per il cancro dell’endometrio nelle donne in postmenopausa: uno studio caso-controllo nella coorte UKCTOCS.Lancetta Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.Linee guida dell’Associazione Europea di Urologia sul cancro della vescica non muscolo-invasivo (TaT1 e carcinoma in situ) -
Aggiornamento 2019.Euro Urol.2019;76: 639-57.
46. Aragona-Ching JB.Sfide e progressi nella diagnosi, nella biologia e nel trattamento dei carcinomi del tratto uroteliale superiore e della vescica.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Colangiocarcinoma: concetti in evoluzione e strategie terapeutiche.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Biopsia liquida nell'epatocellulare
carcinoma: cellule tumorali circolanti e DNA tumorale circolante.Mol Cancro.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Pan-cancro
rilevamento del DNA tumorale circolante in oltre 10.000 pazienti cinesi.Nat Comune.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et al.Nuovi criteri di valutazione della risposta nei tumori solidi: linea guida RECIST rivista (versione 1.1).Eur J Cancro.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST: imparare dal passato per costruire il futuro.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: linee guida per i criteri di risposta da utilizzare negli studi
testare immunoterapici.Lancetta Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Biopsia liquida e malattia residua minima: ultimi progressi e implicazioni per la cura.Nat Rev Clin Oncol.2019;16: 409-24.
Citare questo articolo come: Qian C, Zou X, Li W, Li Y, Yu W. L'avamposto contro il cancro: solo marcatori universali del cancro.Cancro Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Orario di pubblicazione: 07 maggio 2024